糖尿病の歴史6 (古代ローマ: ガレノス)
ガレノス(129-210)はローマ帝国時代のギリシアの医学者です。162年にローマで臨床活動を開始し、皇帝マルクス・アウレリウス・アントニウスの典医になりました。ヒポクラテスの四体液説を継承し、 20分冊からなる医学書を書き、西洋医学に支配的影響を与えました。ガレノスは1500年後のルネサンス期まで権威を保ち、ガレノス医学書を燃やしたパラケルススはバーゼル大学医学部を追放されています。
ガレノスの糖尿病の記述は短く、2人しかいなかったと述べています。栄華をほこったローマ帝国で本当に糖尿病が少なかったのでしょうか、不思議に思います。
平成27年1月16日
ガレノスの糖尿病の記述は短く、2人しかいなかったと述べています。栄華をほこったローマ帝国で本当に糖尿病が少なかったのでしょうか、不思議に思います。
糖尿病、あるいは暴力的口渇、尿瓶の水腫と呼ばれる稀な病気がある。この病気では腎臓が影響を受ける。私はこの病気は2回しか診ていない。患者は消えることのない口渇があり、大量に水を飲む。多飲に似て多尿があり、飲んだ液体はすぐさま尿として排泄される。(ヘンシェン)
平成27年1月16日
糖尿病の歴史5 (古代ローマ: ケルスス)
ケルススは1世紀頃のローマの著述家で、百科事典をいくつか書いています。その中に De Medicina (医学論:医学百科事典)があり、糖尿病がでてきます。西洋における最も古い糖尿病の文章とされますが、彼自身の観察ではなく、周囲に広まっていた知識をまとめあげたものと考えられています。ケルススの医学上の最も有名な仕事は、炎症の4つの徴候(発赤、腫れ、痛み、熱)を記載したことです。この4徴候は今でも大学で習います。 ケルススによる糖尿病の記載を紹介します。
ケルススを意識して「ケルススを凌駕するもの」と自らを名づけた人がいます。のちに紹介するパラケルススです。
平成27年1月13日
苦痛なく尿量が飲水量を超えると、衰弱と危険が引き起こされる。尿が薄い時は陽だまりか暖炉のそばで運動やマッサージが指示される。入浴は回数を減らし、長く浸からない。食物は収れん性のものを摂り、酸っぱいワインを混ぜずに、夏は冷やして、冬は温めて飲む。食物はすべて最小量にする。腸を浣腸やミルクで動かす。尿が濃い時は運動やマッサージを多くし、風呂に長く浸かり、食べ物やワインを軽くする。 (アレン、他)
ケルススを意識して「ケルススを凌駕するもの」と自らを名づけた人がいます。のちに紹介するパラケルススです。
平成27年1月13日
糖尿病の歴史4 (古代ギリシャ: ヒポクラテス)
ヒポクラテスは紀元前460年頃の人です。医学から迷信や呪術的な要素を除外した最初の人で、のちの西洋医学に大きな影響を与え、医学の父と呼ばれています。ヒポクラテスは4種類の体液(血液、粘液、黄胆汁、黒胆汁)に変調が起きた時に病気が生じると考えました(四体液質)。この四体液質の考えは中世まで引き継がれました。
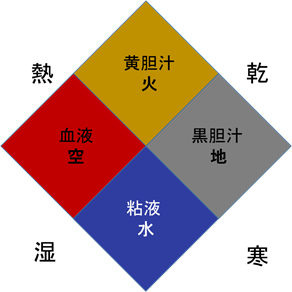
ヒポクラテスは糖尿病という病気を認識しませんでした。流行病の第3巻に「飲んだ量を超えて排尿する患者」がいて「尿路感染で説明できない」と書いていますが、糖尿病であったかどうか不明のようです。当時、糖尿病は少なかったのでしょうか。のちに紹介するガレノスも糖尿病が少ないと書いています。
ヒポクラテスは、また「ヒポクラテスの誓い」でも有名です。これは医師倫理を述べたもので、実際は後代の作と考えられています。インスリンを発見したバンティングは「ヒポクラテスの誓い」を立てていることを理由に、インスリンの特許化を望みませんでした。ちなみに大阪大学では「ヒポクラテスの誓い」ではなく、「扶氏医戒之略」を使います。これはドイツ人医師のフーフェラントによる医師の義務を述べたもので、緒方洪庵以来の伝統です。
平成27年1月9日

ヒポクラテスは糖尿病という病気を認識しませんでした。流行病の第3巻に「飲んだ量を超えて排尿する患者」がいて「尿路感染で説明できない」と書いていますが、糖尿病であったかどうか不明のようです。当時、糖尿病は少なかったのでしょうか。のちに紹介するガレノスも糖尿病が少ないと書いています。
尿が飲んだ量を超える、しかも多く超える病気がある。この尿はとても悪質である、なぜなら適切な濃さでなく、適切に作られた尿でなく、適切に排泄される尿でない。多くの場合、排尿は好ましいものであるが、回数が多くなるとそれは肉体が溶けだしていることを意味する。腸の病気であり、苦痛であり、危機が迫っている。(アレン、他)
ヒポクラテスは、また「ヒポクラテスの誓い」でも有名です。これは医師倫理を述べたもので、実際は後代の作と考えられています。インスリンを発見したバンティングは「ヒポクラテスの誓い」を立てていることを理由に、インスリンの特許化を望みませんでした。ちなみに大阪大学では「ヒポクラテスの誓い」ではなく、「扶氏医戒之略」を使います。これはドイツ人医師のフーフェラントによる医師の義務を述べたもので、緒方洪庵以来の伝統です。
平成27年1月9日
糖尿病の歴史3 (古代インド)
今回は古代インドにおける糖尿病のお話です。
お釈迦さまと同じ頃(紀元前600年頃) に、スシュルタという医師がいました。彼はスシュルタ本集(インドの古典医学書)を残しました。この医学書は8世紀にアラビア語に翻訳され、世界的にもよく読まれたようです。この中に糖尿病に関する記載があります
スシュルタ本集には、「過食、運動不足で肥満を来し、糖尿病(今の2型糖尿病)が起こる」と書いてあります。これだけでも立派な観察ですが、「1型と考えられる糖尿病 」も記載していて驚きます。「先天性で親の種に欠陥があるために起こり、、、痩せている」と書かれています。
当時の食事はどういうものだったでしょう。インドの神々の食事には「あぶり肉」がよく出てきます。「土地のエキスは草食動物が取込み、さらに肉食動物が取り込む。その過程でエキスが濃縮される」と考えられていて、かなり肉食はあったと思われます。菜食主義を進めた仏教、ジャイナ教の力はまだ弱く、 カーストによる食事戒律も弱かったでしょう。今のインド食とはずいぶん異なっていたと思います。なおインドカレーは、中央アジアの文化とインド文化が融合し、そこにアラブ文化が、さらに新大陸の香辛料+ヨーロッパの文化が融合してできたものです(16世紀以降の発展)。
平成27年1月7日
お釈迦さまと同じ頃(紀元前600年頃) に、スシュルタという医師がいました。彼はスシュルタ本集(インドの古典医学書)を残しました。この医学書は8世紀にアラビア語に翻訳され、世界的にもよく読まれたようです。この中に糖尿病に関する記載があります
スシュルタ本集には、「過食、運動不足で肥満を来し、糖尿病(今の2型糖尿病)が起こる」と書いてあります。これだけでも立派な観察ですが、「1型と考えられる糖尿病 」も記載していて驚きます。「先天性で親の種に欠陥があるために起こり、、、痩せている」と書かれています。
当時の食事はどういうものだったでしょう。インドの神々の食事には「あぶり肉」がよく出てきます。「土地のエキスは草食動物が取込み、さらに肉食動物が取り込む。その過程でエキスが濃縮される」と考えられていて、かなり肉食はあったと思われます。菜食主義を進めた仏教、ジャイナ教の力はまだ弱く、 カーストによる食事戒律も弱かったでしょう。今のインド食とはずいぶん異なっていたと思います。なおインドカレーは、中央アジアの文化とインド文化が融合し、そこにアラブ文化が、さらに新大陸の香辛料+ヨーロッパの文化が融合してできたものです(16世紀以降の発展)。
平成27年1月7日